A Tabela Periódica organiza os elementos
químicos até então conhecidos em uma ordem crescente de número atômico
(Z – quantidade de prótons no núcleo do átomo).
Muitas
propriedades químicas e físicas dos elementos e das substâncias simples
que eles formam variam periodicamente, ou seja, em intervalos regulares
em função do aumento (ou da diminuição) dos números atômicos. As
propriedades que se comportam dessa forma são chamadas de propriedades periódicas.
As principais propriedades periódicas químicas dos elementos são: raio atômico, energia de ionização, eletronegatividade, eletropositividade e eletroafinidade. Já as físicas são: pontos de fusão e ebulição, densidade e volume atômico.
A seguir, veja mais detalhadamente as propriedades periódicas químicas:
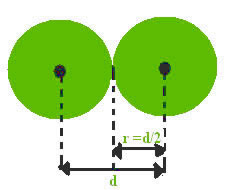
1- Raio atômico:
pode ser definido como a metade da distância (r = d/2) entre os núcleos
de dois átomos de um mesmo elemento químico, sem estarem ligados e
assumindo os átomos como esferas:
Na tabela periódica, o raio atômico aumenta de cima para baixo e da direita para a esquerda.
 Isso
acontece porque em uma mesma família (coluna), as camadas eletrônicas
vão aumentando conforme se desce uma “casa” e, consequentemente, o raio
atômico aumenta. Em um mesmo período (linha), o número de camadas
eletrônicas é o mesmo, mas a quantidade de elétrons vai aumentando da
esquerda para a direita e, com isso, a atração pelo núcleo aumenta,
diminuindo o tamanho do átomo.
Isso
acontece porque em uma mesma família (coluna), as camadas eletrônicas
vão aumentando conforme se desce uma “casa” e, consequentemente, o raio
atômico aumenta. Em um mesmo período (linha), o número de camadas
eletrônicas é o mesmo, mas a quantidade de elétrons vai aumentando da
esquerda para a direita e, com isso, a atração pelo núcleo aumenta,
diminuindo o tamanho do átomo.
2. Energia ou potencial de ionização: é a energia mínima necessária para remover um elétron de um átomo ou íon no estado gasoso.
Esse elétron é sempre retirado da última camada eletrônica, que é a mais externa e é conhecida como camada de valência.
Quanto
maior o raio atômico, mais afastados do núcleo os elétrons da camada de
valência estarão, a força de atração entre eles será menor e,
consequentemente, menor será a energia necessária para retirar esses
elétrons e vice-versa. Por isso, a energia de ionização dos elementos
químicos na Tabela Periódica aumenta no sentido contrário ao aumento do
raio atômico, isto é, de baixo para cima e da esquerda para a direita:

4. Eletropositividade:
é a capacidade que o átomo possui de se afastar de seus elétrons mais
externos, em comparação a outro átomo, na formação de uma substância
composta.
Visto que é o contrário da
eletronegatividade, a sua ordem crescente na tabela periódica também
será o contrário da mostrada para a eletronegatividade, ou seja, será de
cima para baixo e da direita para a esquerda:

5. Eletroafinidade ou afinidade eletrônica: corresponde à energia liberada por um átomo do estado gasoso, quando ele captura um elétron.
Essa energia é chamada assim porque ela mostra o grau de afinidade ou a intensidade da atração do átomo pelo elétron adicionado.
Infelizmente,
não são conhecidos todos os valores para as eletroafinidades de todo os
elementos, mas os que estão disponíveis permitem generalizar que essa
propriedade aumenta de baixo para cima e da esquerda para a direita na
Tabela Periódica:

Nenhum comentário:
Postar um comentário